Le trasformazioni strutturali delle proteine all'interno delle cellule possono essere osservate in diretta e con una risoluzione spaziale di poche decine di nanometri grazie a una nuova tecnica di microscopia a fluorescenza sviluppata dal gruppo di ricerca di Eric Betzig, premio Nobel per la chimica nel 2014 proprio per i suoi contributi allo sviluppi di metodi di microscopia avanzata
La microscopia a illuminazione strutturata (structured illumination microscopy, SIM) uno dei metodi più raffinati per osservare i processi che avvengono nelle cellule, può ora raggiungere una risoluzione spaziale molto spinta grazie a due nuove tecniche descritte su "Science" da una collaborazione internazionale di ricerca di cui fa parte tra gli altri Eric Betzig, dell'Howard Hughes Medical Institute, premio Nobel per la chimica nel 2014 proprio per i suoi contributi allo sviluppo di metodi di microscopia avanzata.
Tra questi ultimi ci sono la microscopia di localizzazione fotoattivata (photoactivated localization microscopy, PALM), e la deplezione mediante emissione stimolata (stimulated emission depletion, STED), che sfruttano entrambe il fenomeno della fluorescenza o della fosforescenza delle sostanze organiche o inorganiche contenute nel campione. Grazie alla PALM e alla STED, le osservazioni microscopiche hanno raggiunto il dominio della super-risoluzione, per la loro capacità di distinguere due punti separati da poche decine di nanometri (miliardesimi di metro).
Il rovescio della medaglia, come ha spiegato lo stesso Betzig, è che con questi due metodi i campioni sono illuminati da una radiazione così intensa che le proteine marcate a fluorescenza "si spengono" velocemente, danneggiando il campione stesso e rendendo impossibile l'osservazione prolungata.
Questi inconvenienti possono essere superati, con interessanti prospettive per gli studi di biologia, dalle versioni avanzate della SIM. Nella versione convenzionale della SIM, il campione sotto la lente è investito da diversi schemi d'illuminazione in successione e la sua "risposta" viene catturata da una sensore digitale da diversi angoli. In seguito un apposito programma traduce il segnale registrato dal processore in un modello della struttura tridimensionale del campione. Quella che mancava finora era la super-risoluzione.
Betzig e colleghi hanno integrato nella SIM la tecnica di base della STED, in cui le proteine marcate dalla fluorescenza possono essere "accese" o "spente" mediante impulsi di luce: inizialmente le "etichette" fluorescenti di una proteina vengono tutte accese; in seguito un impulso di luce ne disattiva la maggior parte. Questo processo viene ripetuto 25 volte o più, generando immagini molto incise e definite, ma non è adatto alla cattura di immagini di cellule viventi perché troppo lento.
"Il problema con questo approccio è che le molecole spente non contribuiscono all'immagine, ma sono stressate perché investite due volte dalla radiazione", ha spiegato Betzig. "Inoltre richiede molto più tempo di quanto ve ne sia a disposizione, perché la cellula è in costante movimento".
La soluzione escogitata da Betzig è semplice, almeno in linea di principio.
"In effetti non è necessario attivare tutte le molecole: in questo nuovo metodo, denominato patterned photoactivation non-linear SIM, si inizia accendendo solo un sottoinsieme di etichette fluorescenti di un campione con uno schema di illuminazione, che fornisce comunque un'informazione ad alta risoluzione", ha aggiunto il premio Nobel.
La patterned photoactivation non-linear SIM cattura 25 istantanee per realizzare un'immagine finale in circa 30 centesimi di secondo. Grazie all'alta efficienza con cui viene effettuato il processo, anche con una radiazione luminosa di bassa intensità è possibile catturare tutta l'energia emessa dalla fluorescenza, preservando le etichette e usando il microscopio più a lungo, così da arrivare a una risoluzione spaziale di 62 nanometri.
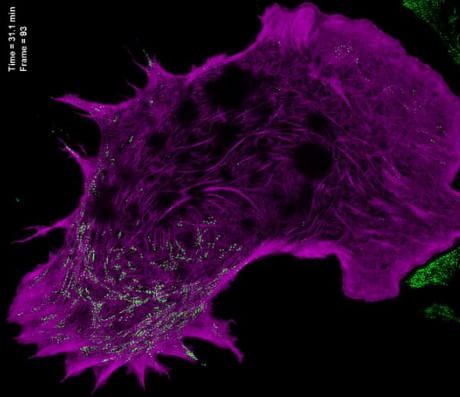
I ricercatori hanno dimostrato la validità della nuova tecnica realizzando video di rottura e riassemblaggio strutturale di proteine mentre le cellule si muovono e cambiano forma, oppure la dinamica di piccole cavità della superficie cellulare note come caveole.
Il gruppo di Betzig ha anche dimostrato la fattibilità di un metodo per portare la risoluzione della SIM a 84 nanometri accoppiandola con un obiettivo da microscopio convenzionale dotato di un'elevata apertura numerica (l'equivalente dell'apertura relativa degli obiettivi delle fotocamere). Questa apertura limita l'esposizione della luce a una frazione molto piccola, limitando il danno alle cellule e alle molecole fluorescenti, consentendo l'osservazione in diversi colori allo stesso tempo, il che rende la metodica adatta all'osservazione simultanea di differenti proteine.
Fonte: http://www.lescienze.it/news/2015/08/31/news/micro...